MENU


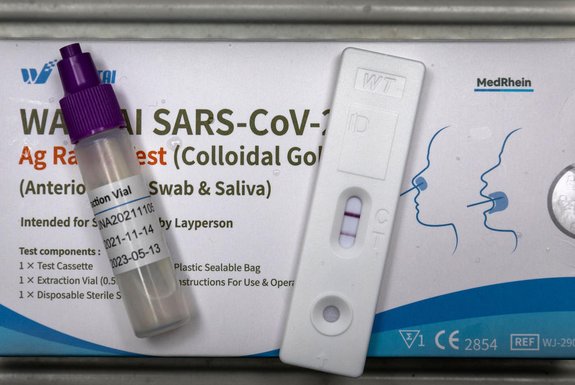
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou por unanimidade a liberação da venda e do uso do autoteste para covid-19 no Brasil. Com isso, abre a possibilidade de realização do exame pela própria população, que faz a coleta e interpreta o resultado, positivo ou negativo, de acordo com as instruções do fabricante.
Os quatro diretores presentes na reunião extraordinária, desta sexta-feira (28), votaram a favor. O diretor-presidente da Anvisa, Antonio Barra Torres, não esteve presente por motivos pessoais, após um problema de saúde na família.
A decisão veio após a Anvisa ter adiado o tema em reunião na semana passada, cobrando do Ministério da Saúde mais informações sobre a política pública de autotestagem, orientações à população e notificação de casos positivos nas estatísticas oficiais. A pasta respondeu à agência no início desta semana, justificando que a autotestagem é uma estratégia de triagem e que pode ajudar na quebra da transmissão da doença.
A diretora Cristiane Jourdan, relatora do caso, destacou que o autoexame para covid-19 pode ser uma importante ferramenta em um momento de aumento de casos provocado pelo avanço da variante Ômicron.
– Considerando o exponencial aumento do número de casos em decorrência da variante Ômicron, a elaboração de diretrizes do Ministério da Saúde sobre o uso dos autotestes, relacionadas à política nacional de testagem para a covid-19, e a missão institucional desta Anvisa na proteção da saúde pública, entendo ser relevante e urgente a abertura de processo regulatório e deliberação de Resolução da Diretoria Colegiada (RDC) que dispõe sobre o registro de dispositivos de autoteste para detecção de antígeno de SARS-Cov-2 – disse em seu voto.
Os diretores Rômison Mota, Alex Machado Campos e Meiruze Freitas acompanharam o voto da relatora.
A partir de agora, a Anvisa irá publicar a resolução que libera o uso do autoteste para covid no Diário Oficial da União (DOU).
Os exames ficarão disponíveis para compra em farmácias e, em um primeiro momento, não serão distribuídos de forma gratuita pelo Sistema Único de Saúde (SUS). Para que a venda comece a ocorrer, porém, os fabricantes de autotestes terão que solicitar registro na Anvisa.
– É preciso que uma empresa regularizada venha à Anvisa e registre o autoteste. E a partir de uma avaliação criteriosa, ela tenha a aprovação e, após a aprovação, ela seja disponibilizada ao estabelecimento de venda – disse a diretora Meiruze, que conduziu a reunião com a ausência de Barra Torres.
Todo caso positivo obtido por um autoteste deverá ser notificado nos sistemas públicos. Para isso, no entanto, a pessoa precisará se deslocar a um posto de saúde, de onde será feita a comunicação ao MS. Não será disponibilizada uma plataforma online para registro.
O Ministério da Saúde também cita os casos em que o autoteste para covid-19 pode ou não pode ser usado. O exame é indicado para ampliar as “oportunidades de testagem para indivíduos sintomáticos, assintomáticos e seus possíveis contatos”, “realizar o isolamento precoce e quebrar a cadeia de transmissão” e “sair do isolamento, após resultado de teste negativo, desde que assintomático e no período recomendado”.
O autoteste não é indicado para apresentação de resultado negativo para coronavírus em viagens internacionais, para licença médica laboral, realização em terceiros, para pessoas com sintomas graves, como falta de ar e confusão mental, ou para definir diagnóstico. “O autoteste deve ser realizado apenas para triagem”, ainda cita o documento.
Com o autoteste, o paciente coleta a sua própria amostra e interpreta o resultado com as instruções do fabricante. O teste usado geralmente é o de antígeno, feito por profissionais de saúde em farmácias e em postos de saúde, por exemplo. O resultado sai em até 20 minutos.
GAÚCHA ZH